Американские ученые создали новую мышиную модель, которая впервые имитирует акне у человека, и использовали ее, чтобы подтвердить концепцию хороших и плохих для акне бактерий. Эта модель представляет новые возможности для целевого лечения и разработки вакцин.
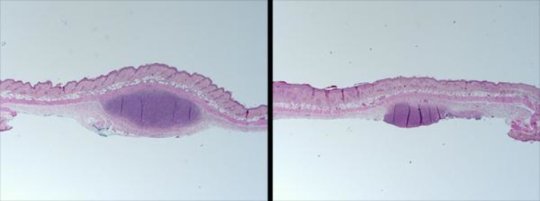
Рис. 1 Кожу мыши обрабатывают синтетическим кожным салом человека, вводят штаммы P. acnes, связанные с появлением акне (слева), или P. acnes, связанные со здоровьем (справа), и просматривают под микроскопом. Источник: UC San Diego Health
Ученые долго полагали, что Propionibacterium вызывают акне. Однако эти бактерии в изобилии встречаются на коже каждого человека, но акне страдают не все. Генетическое секвенирование недавно показало, что не все P. acnes одинаковы, существуют разные штаммы, некоторые из которых в изобилии присутствуют в очагах угрей, а некоторые никогда там не обнаруживаются.
Тем не менее исследования прыщей и разработка терапевтических решений были затруднены из-за отсутствия животной модели, которая воспроизводила бы акне человека. Например, при введении мышам P. acnes не вызывают долговременных поражений кожи, а иммунная система мыши быстро справляется с этими бактериями. Однако теперь исследователи разработали новую мышиную модель, которая очень напоминает акне человека. В своих экспериментах они использовали синтетический кожный жир, воскоподобное выделение кожи, которое увеличивается в подростковом возрасте.
Впервые модель «человеческих» прыщей, описанная в статье, опубликованной 7 марта 2019 года в JCI Insight, позволила исследователям напрямую сравнивать хорошие (связанные со здоровьем) и плохие (связанные с прыщами) штаммы бактерий P. аcnes.
«Поскольку мы точно знаем, какими генами различаются эти штаммы, мы можем точно определить, почему акне-ассоциированные штаммы вызывают поражения кожи, – сказал Джордж Ю. Лю, доктор медицинских наук, профессор и руководитель отделения детских инфекционных болезней в медицинской школе Калифорнийского университета в Сан-Диего. – И эта информация поможет нам разработать новые методы лечения, которые конкретно блокируют эти факторы, способствующие появлению прыщей, или изменят баланс химического состава кожи человека в пользу здоровых штаммов».
Лю и его команда подготовили синтетическое кожное сало, смешав в отношениях, которые напоминают кожное сало человека, четыре ингредиента: жирную кислоту, триглицерид, воск и сквален – соединение-предшественник стеролов, таких как холестерин и стероидные гормоны. Надо сказать, что мыши тоже выделяют кожное сало, но его состав отличается.
«Когда мы начали работать с бактериями P. аcnes и проверили модели животных, которые использовали другие исследователи на протяжении многих лет, мы подумали, что должны придумать что-то лучшее, – отметил Лю. – Прыщи обычно возникают, когда человек достигает подросткового возраста… Какая разница между кожей ребенка и кожей подростка? Увеличение выработки кожного сала. И мы были удивлены, обнаружив, как столь простое дополнение повлияло на нашу возможность изучать акне на животных моделях».
Исследователи прививали мышам P. acnes и ежедневно наносили свежий кожный жир. Без кожного сала у мышей были минимальные повреждения и бактерии быстро элиминировались. При использовании одного только кожного сала не было никакого воздействия на кожу.
Но когда ученые соединили инъекции P. acnes с применением кожного сала, они увидели нечто похожее на человеческие прыщи, и бактерии выживали в течение нескольких недель. Также эти штаммы P. acnes вызывали воспаление, которое выражалось в повышенном уровне воспалительных молекул, называемых цитокинами.
Затем исследователи попытались повторить то же самое, используя ассоциированные со здоровьем штаммы P. аcnes, которые не обнаруживаются в очагах акне у человека. Через три дня после инокуляции на коже присутствовало одинаковое количество бактерий, независимо от применяемого штамма. Но различия между штаммами легко определялись визуально. Поражения, вызванные акне-ассоциированными штаммами P. Аcnes, были выражены значительно сильнее (в два раза). Это касалось таких характеристик, как размер поражения, покраснение, сухость и степень шелушения кожи.
В отличие от людей все мыши в этих экспериментах были генетически идентичны. Это говорит о том, что различия в интенсивности угрей вызваны только генетическими различиями между бактериальными штаммами и не имеют отношения к врожденному иммунитету мышей.
Команда надеется улучшить свою мышиную модель акне и достичь аналогичных результатов при местном нанесении бактерий (без инъекций под кожу). Они также хотят изучить гены, которые являются уникальными для акне-ассоциированных штаммов P. acnes, и определить, что именно в кожном сале человека способствует распространению этих штаммов.
Лю сказал, что эта информация может помочь лучше понять, кто подвержен повышенному риску появления прыщей и как разработать персонализированные методы лечения акне и вакцины, направленные на подавление стимулирующих появление прыщей бактериальных факторов или компонентов кожного сала.
Источник
Stacey L. Kolar, Chih-Ming Tsai, Juan Torres, Xuemo Fan, Huiying Li, George Y. Liu. Propionibacterium acnes-induced immunopathology correlates with health and disease association. JCI Insight, 2019; 4 (5) DOI: 10.1172/jci.insight.124687


